격주 목요일 오전 8시, 따끈따끈한 생물정보학 업계 소식이 당신을 찾아갑니다 |
안녕하세요, 생정해요 편집부의 파랑새입니다.
어느덧 올해 보내드리는 마지막 뉴스레터입니다. 낙엽이 질때 제가 개인적인 도전으로 시작한 '생정해요'는 어느덧 3개월간 5편의 뉴스레터를 보내드릴 수 있게 되었습니다.
요즈음은 연말이라 그런지 연구에 잘 집중이 안되는 것 같습니다. 기술은 너무나 빠르게 발전하고, 또 구체화되고 있어 제가 하고 있는 연구가 가치가 있는지, 또 내가 산업계에서 인정을 받을 수 있을지에 대한 두려움이 크게 옵니다. 하지만 그럼에도 중요한 것은, 제가 걸어온 길과 앞으로 나아갈 길이겠지요. 과거에 걸었던 길이 나를 증명하는 것처럼, 오늘 걸어갈 길이 내일의 나를 증명할 것이라고 생각합니다. 깊이 고민하여 선택한뒤, 한번 선택한 뒤에는 과거의 나를 믿고 뚜벅뚜벅 걸어가는 것. 그것이 결국 풍파같은 연구에서 나를 지켜낼 수 있는 닻이 될꺼라 생각합니다.
오늘의 생정해요도 알찬 소식으로 담았습니다. 그럼 구독자 여러분들도, 미리 새해복 많이 받으시길 소망합니다.
- 24년 12월 24일 연구실에서, 파랑새 |
 |
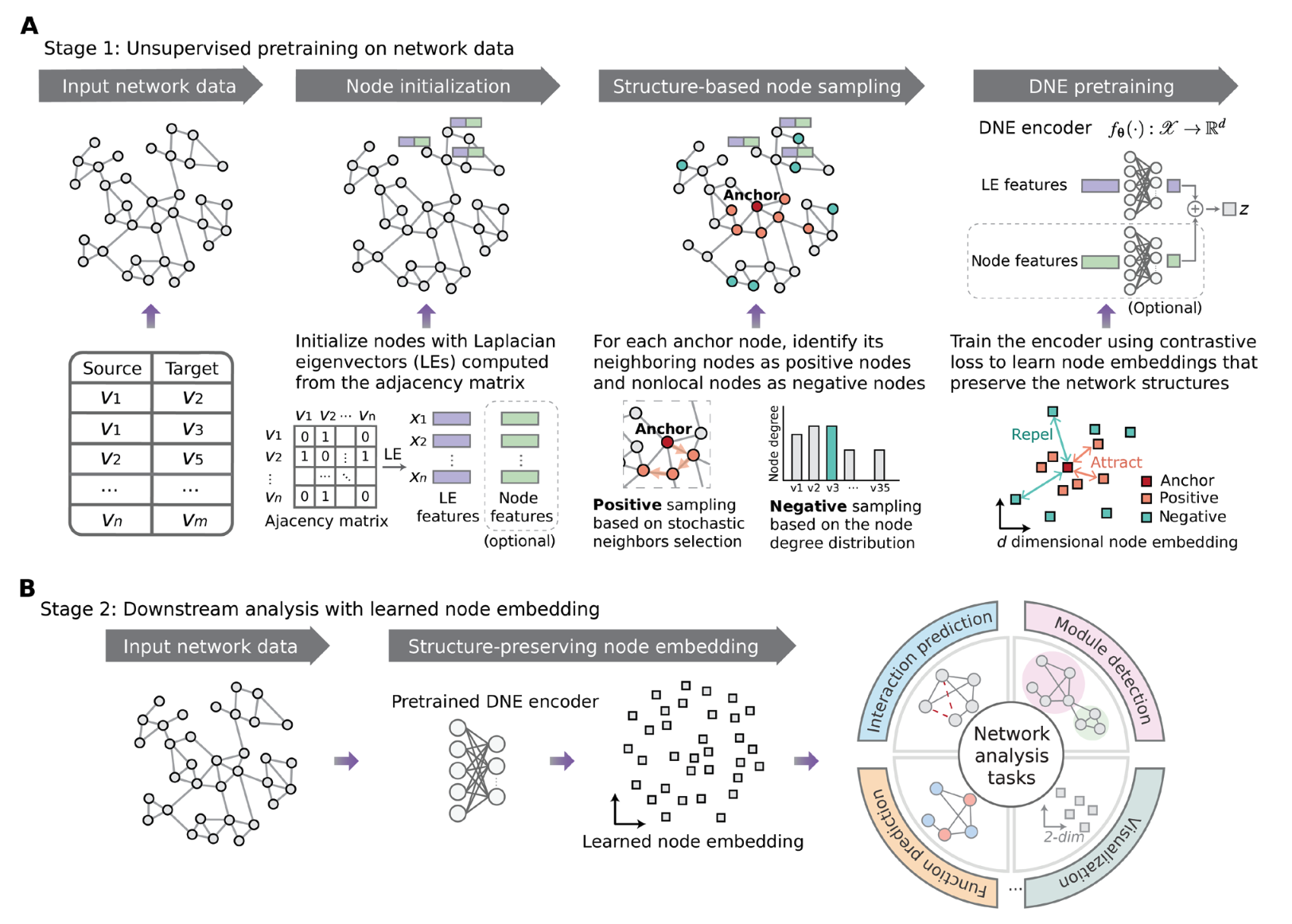 | 《Science Advances (IF: 14.96)》 Deep representation learning of protein-protein interaction networks for enhanced pattern discovery 발간날짜: 2024/12/18 저자: Rui Yan, Md Tauhidul Islam, Lei Xing
단백질-단백질 상호작용(PPI) 네트워크는 세포 과정과 질병 메커니즘을 이해하는 데 중요한 도구로 여겨져 왔으나, 이러한 네트워크의 복잡성 때문에 신뢰할 수 있는 패턴을 발견하는 데 한계가 있었습니다. 기존의 네트워크 임베딩 방법은 주로 국소적 또는 제한된 구조적 관계를 다뤘으며, 고차원적이고 비선형적인 네트워크의 전체적인 관계에는 약점을 보였습니다. 이 논문은 Discriminative Network Embedding(DNE)이라는 새로운 딥러닝 기반 프레임워크를 제안하며, 노드 간의 지역적 및 전역적 상호작용을 통합적으로 모델링하여 네트워크 내 패턴 탐색의 정확성을 크게 향상시켰습니다. DNE는 인접 노드와 먼 노드 간 표현의 비선형 대비를 활용하여 기존 방법보다 뛰어난 성능을 보여줍니다. 특히 Arabidopsis thaliana, Caenorhabditis elegans, Saccharomyces cerevisiae, 그리고 인간 PPI 네트워크에서의 링크 예측 및 노드 클러스터링(기능 모듈 식별) 작업에서 우수한 결과를 입증했습니다. 또한, 단백질 서열 데이터를 통합하여 PPI 네트워크의 표현력을 더욱 향상시키는 유연성을 제공합니다. 이 연구는 생물학적 네트워크 분석에서 새로운 표준을 제시하며, 질병 유전자 예측 및 단백질 기능 연구와 같은 다양한 응용 분야에서 활용될 가능성을 제시합니다. | |
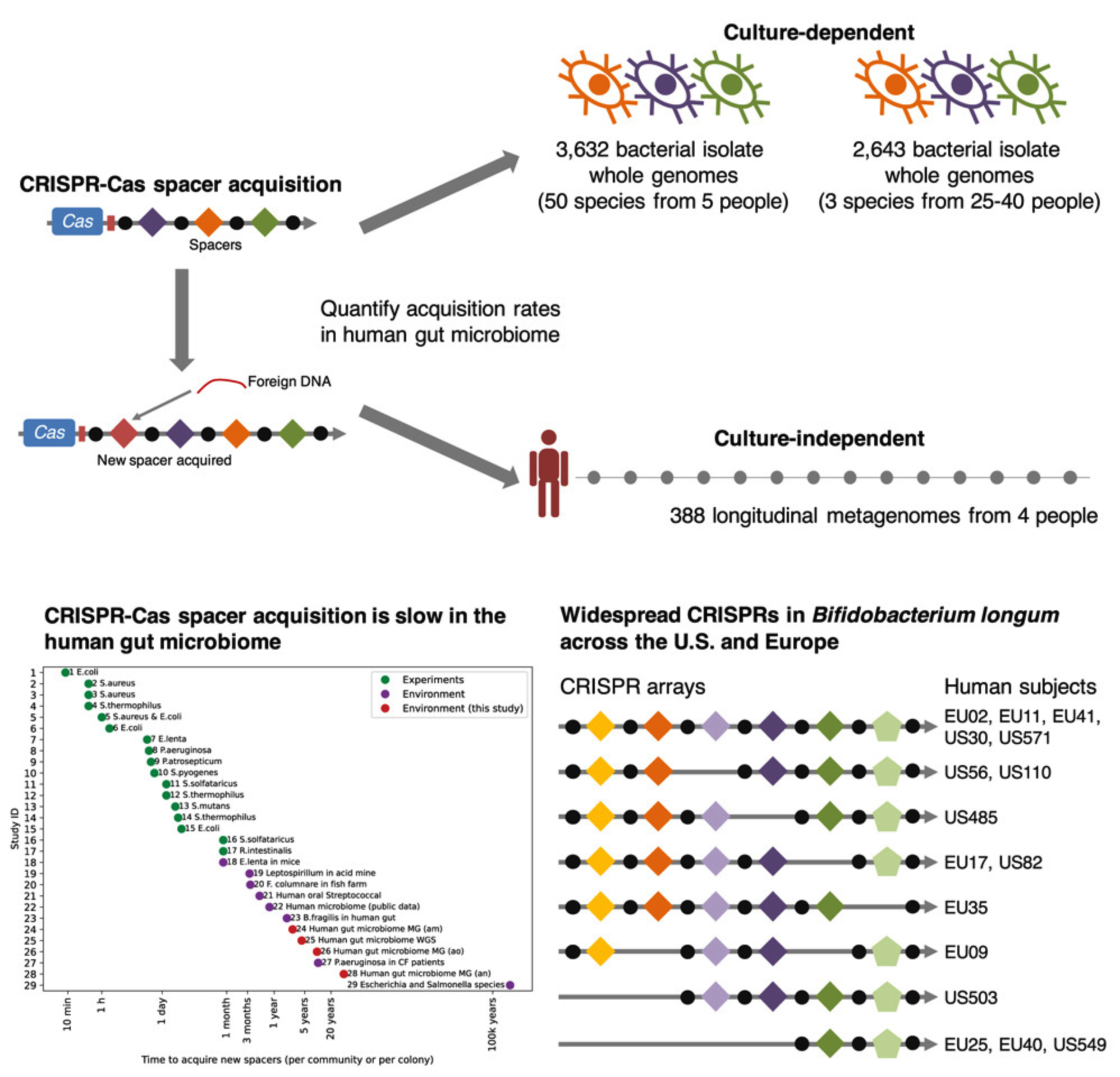 | 《Cell Genomics (IF: 10.52)》 CRISPR-Cas spacer acquisition is a rare event in human gut microbiome 발간날짜: 2025/01/08 저자: An-Ni Zhang et al.
CRISPR-Cas 시스템은 세균과 고세균이 파지 감염으로부터 스스로를 보호하기 위해 진화한 적응 면역 체계로, 새로운 스페이서를 추가하며 숙주-파지 상호작용의 기록을 업데이트한다고 알려져 있습니다. 일반적으로, 환경 미생물군에서는 비교적 빠르게 스페이서 획득이 이루어지는 것으로 보고되어 왔습니다. 그러나 이 논문은 인간 장내 미생물군에서는 CRISPR 스페이서 획득이 극히 드물며, 약 2.7년에 하나씩 추가된다는 점을 새롭게 밝혔습니다. 연구진은 3,632개의 게놈 및 메타게놈 데이터를 분석하여, 기존의 환경 기반 연구와 비교해 장내 미생물군에서 CRISPR-Cas 시스템의 면역 업데이트가 상대적으로 느린 이유를 조사했습니다. 특히, Bifidobacterium longum에서 수평적 유전자 전달(HGT)을 통해 CRISPR 배열 전체가 전파되며, 지역적 스페이서 획득보다 최대 3배 더 많은 스페이서를 생성한다는 사실도 발견했습니다. 이 연구는 CRISPR-Cas 시스템의 느린 적응 속도가 숙주-파지 상호작용의 안정성과 장내 미생물군의 진화적 특성을 반영할 수 있음을 시사하며, 기존의 생태학적 연구와 장내 미생물 환경 간의 차이를 설명하는 데 중요한 기여를 합니다. CRISPR 배열의 활용 가능성을 확장하며, 장내 미생물군에서 숙주-파지 간 진화적 경쟁의 동역학을 이해하는 데 새로운 관점을 제공합니다. | |
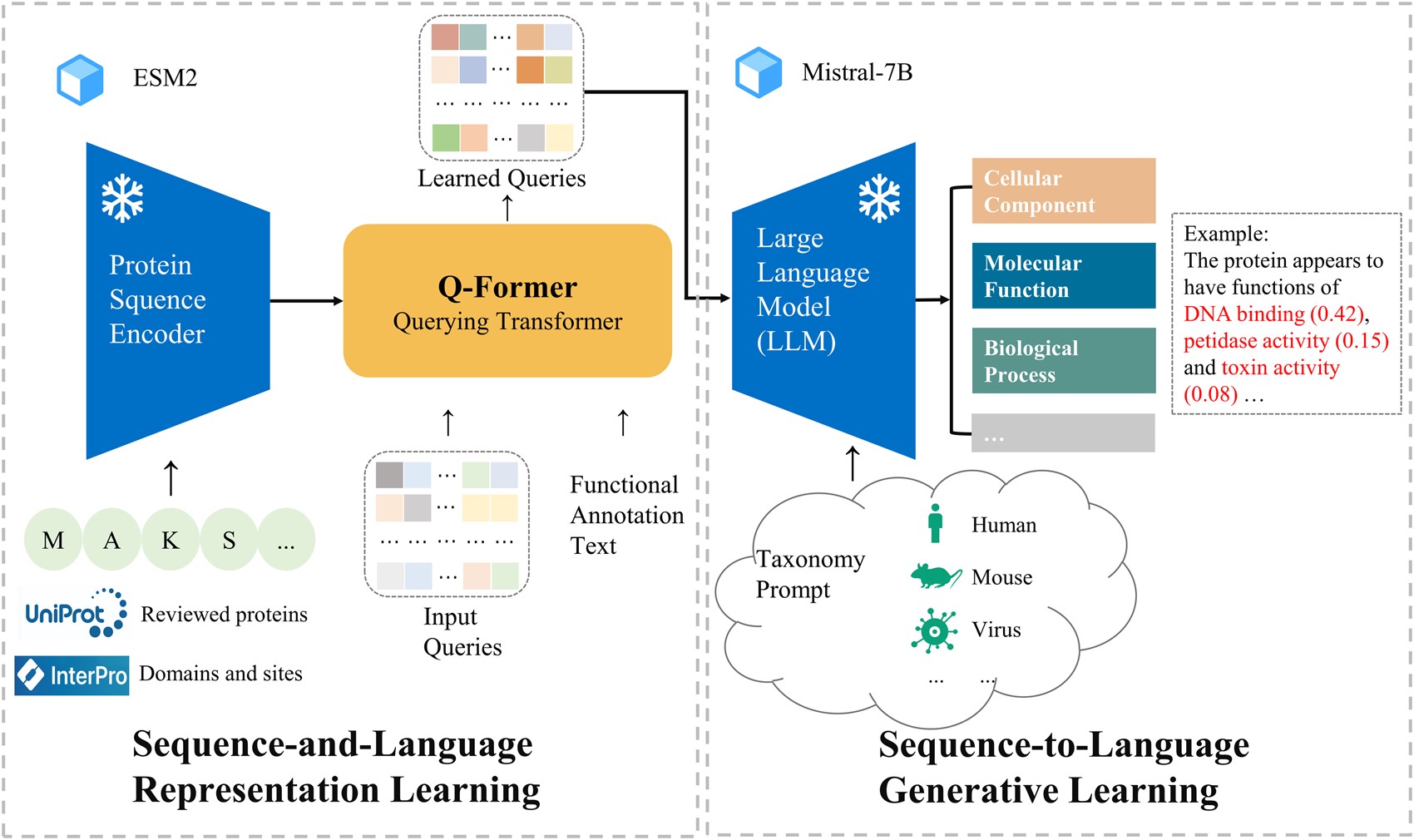 | 《Bioinformatics (IF: 6.93)》 FAPM: Functional annotation of proteins using multimodal models beyond structural modeling 발간날짜: 2024/11/14 저자: Wenkai Xiang et al.
기존 단백질 기능 예측 모델은 서열과 구조 정보를 활용해왔으나, 구조적 데이터의 부족과 드문 기능 레이블(tail labels)의 예측에서 한계가 있었습니다. 이 논문은 단백질 서열과 자연어 주석을 통합적으로 학습하는 대조학습 기반 멀티모달 모델 FAPM을 제안하여 이러한 문제를 해결합니다. FAPM은 Gene Ontology(GO) 용어와 촉매 활동을 예측하는 데 있어 뛰어난 성능을 보였으며, 기존 모델과 비교해 상동성이 낮은 서열에서도 우수한 결과를 보여줍니다. 공공 벤치마크 및 내부 실험에서 기존 모델을 능가하며, 특히 희소한 데이터에서도 높은 신뢰성을 확보했습니다. 이 연구는 단백질 기능 연구에 텍스트 기반 정보 활용을 확장하며, 단백질 설계와 생물학적 발견에 새로운 가능성을 열었습니다. | |
'R&D 예산 최소 5% 이상 편성 의무화 추진'
조승래 의원 (대전 유성갑)을 대표로 정부 총 예산의 5%를 연구개발에 의무적으로 편성캐하는 법안이 발의되었습니다. 현재 정부는 국가과학기술자문회의 심의를 무시하고 R&D 예산을 대폭 삭감하여 위법성 논란이 일었는데요, 해당 법안을 통해 연구환경이 안정될 수 있기를 희망합니다.
'국가통합바이오빅데이터 출범'
보복부, 과기부, 산통부, 질병청등이 합작하여 추진한 국가통합바이오빅데이터구축사업이 12월 19일 출범하였습니다. 이는 희귀질환자, 중증질환자, 건강인들의 임상정보와 유전체 데이터를 통합 관리하는 대규모 프로젝트인데요. 8년간 100만명의 빅데이터 구축을 목표로 진행되며, 해당 데이터는 26년부터 대학과 병원에 개방될 예정입니다.  |
 | 유전자를 껏다가, 켰다가. AI 기반 유전자 스위치 설계 기술은 생물학과 의학 연구에서 큰 혁신을 가져왔습니다. 기존의 유전자 편집 기술이 전신에 걸쳐 유전자를 수정하는 데 초점이 맞춰져 있었다면, 잭슨 연구소의 라이언 투이 박사를 포함한 다국적 연구팀이 주도한 이번 연구는 특정 세포나 조직에서만 유전자를 조절할 수 있는 새로운 가능성을 열었습니다. 이는 DNA 조절 요소(CREs)의 복잡한 “문법”을 AI가 학습하여, 자연적으로 존재하지 않는 합성 CRE를 설계한 덕분입니다. 특히, 연구진은 혈액, 간, 뇌 세포와 같은 다양한 세포에서 유전자 발현을 예측하고 이를 제어하는 AI 모델을 구축했습니다. 이를 통해 특정 조직에서만 작용하는 유전자 편집 기술이 가능해졌고, 자연적인 CRE보다 높은 효율성과 특이성을 가진 합성 CRE의 설계가 실현되었습니다. 이 혁신은 유전자 편집의 새로운 가능성을 제시하며, 의학과 생물학 연구의 속도와 정확도를 크게 향상시킬 것입니다.
이 기술이 가지는 긍정적인 효과는 여러 방면에서 기대를 모으고 있습니다. 첫째, 특정 조직이나 세포 유형에 맞춘 유전자 발현 조절은 질병 치료의 정밀도를 높여 부작용을 줄일 가능성을 제시합니다. 예를 들어, 간에서만 작용하는 약물 전달 시스템이나 특정 세포에서만 활성화되는 유전자 치료법은 치료 효과를 극대화하고, 주변 조직이나 전신에 미칠 수 있는 부작용을 최소화할 수 있습니다. 둘째, 이번 연구에서 설계된 합성 CRE는 자연적으로 존재하는 CRE보다 더 높은 세포 특이성을 보여주었으며, 이는 새로운 생물학적 연구와 의약품 개발에 있어 강력한 도구로 자리 잡을 것입니다. 셋째, 이러한 합성 CRE가 동물 모델에서도 긍정적인 결과를 보였다는 점은, 이 기술이 실험실 단계에서 나아가 임상적으로 적용될 가능성을 한층 높여줍니다. 이는 새로운 치료법 개발의 속도를 가속화할 뿐 아니라, 환자 맞춤형 치료를 가능하게 하는 중요한 기반이 될 수 있습니다.
하지만 이처럼 획기적인 기술이 가져올 수 있는 가능성만큼이나, 우리가 염려해야 할 문제들도 존재합니다. 첫째, AI가 설계한 CRE의 안전성과 예측 가능성을 장기적으로 검증할 필요가 있습니다. 실험 단계에서는 높은 정확도를 보였더라도, 인간을 대상으로 한 임상 시험에서는 예상치 못한 부작용이나 위험 요소가 나타날 수 있습니다. 특히, 이러한 유전자 조절이 특정 조직에 국한되지 않고 의도하지 않은 다른 조직에서 발현될 가능성은 여전히 존재하며, 이는 생명 윤리와 안전성 문제로 이어질 수 있습니다. 둘째, 이 기술의 오용 가능성에 대한 우려도 제기되고 있습니다. 특정 세포나 조직에서만 작용하는 유전자 스위치가 생물학적 무기로 악용될 경우, 국제적 규제와 윤리적 합의가 필요합니다. 이러한 악용 가능성은 기술의 윤리적 사용에 대한 더욱 철저한 논의를 필요로 합니다. 셋째, AI 기반 생물학 기술이 점점 더 정교해짐에 따라, 이를 이해하고 활용할 수 있는 전문가 교육과 기술 격차 해소가 필수적입니다. 기술을 충분히 이해하지 못한 채 도입될 경우, 일부 국가나 지역은 이 첨단 기술에서 소외될 수 있으며, 이는 글로벌 의료 불평등 문제를 심화시킬 우려를 낳습니다.
하지만 그럼에도, AI 기반 유전자 스위치 설계 기술은 생물학과 의학 분야에서 매우 혁신적인 도구임이 분명합니다. 이 기술은 특정 세포나 조직에서만 유전자를 조절할 수 있는 가능성을 열어줌으로써, 질병 치료의 정밀성을 높이고 새로운 치료법을 개발할 수 있는 기반을 제공합니다. 하지만 이러한 기술의 안전성과 윤리성을 보장하기 위해서는 충분한 검증과 지속적인 논의, 그리고 이를 지원할 규제와 교육 체계가 필수적입니다. 기술의 진보가 밝은 미래를 약속할 뿐 아니라, 새로운 윤리적 문제와 사회적 과제를 가져올 수 있다는 점을 인지해야 합니다. 유전자 가위의 진보, 과연 어디까지일까요? 우리가 신의 영역에 도전하는 것은 아닐까요. |
 |
|